कार्बन और उसके यौगिक
आप क्या सीखेंगे:
- कोवैलेंट बॉन्ड से बनने वाले अणुओं और कंपाउंड का लेविस डॉट संरचना बनाना।
- कार्बन की असंख्य कंपाउंड बनाने की क्षमता।
- सैचुरेटेड और अनसैचुरेटेड हाइड्रोकार्बन, फंक्शनल ग्रुप और होमोलोगस सीरीज।
- कार्बन कंपाउंड का नामकरण
- एथेनॉल और एथेनॉइक एसिड के रासायनिक गुण
- साबुन और डिटर्जेंट की सफाई करने की क्षमता
कार्बनिक कंपाउंड: जो कंपाउंड कार्बन से बने होते हैं उन्हें कार्बनिक या ऑर्गेनिक कंपाउंड कहते हैं। शुरु शुरु में जिन कार्बनिक कंपाउंड के बारे में पता चला वे सभी जीवों; यानि ऑर्गेनिक स्रोत से आते थे, इसलिये इन्हें ऑर्गेनिक कंपाउंड कहते हैं। पृथ्वी की भूपर्पटी में केवल 0.02% कार्बन है और वायुमंडल में केवल 0.03% कार्बन है। इतना कम कार्बन होने के बावजूद हमारे आस पास पाये जाने वाले असंख्य पदार्थों में कार्बन मौजूद है। इससे कार्बन के महत्व का पता चलता है।
कोवैलेंट बॉन्ड
दो या अधिक परमाणुओं के बीच इलेक्ट्रॉन की साझेदारी से बनने वाले बॉन्ड को कोवैलेंट बॉन्ड कहते हैं। इस तरह के बॉन्ड से बनने वाले कंपाउंड को कोवैलेंट कंपाउंड कहते हैं।
कोवैलेंट बॉन्ड बनने का कारण: इसे समझने के लिये कार्बन के इलेक्ट्रॉनिक कंफिगरेशन को देखते हैं।
C(6): 2, 4
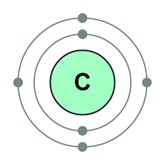
कार्बन की बाहरी कक्षा में 4 इलेक्ट्रॉन होते हैं। इसका मतलब है कि कार्बन एक स्टेबल कंफिगरेशन पाने के लिये निम्नलिखित में से कोई एक विधि अपना सकता है:
- अपनी बाहरी कक्षा को पूरी तरह भरने यानि अष्टक बनाने के लिये यह चार इलेक्ट्रॉन ले सकता है।
- अपनी बाहरी कक्षा को पूरी तरह भरने के लिये यह चार इलेक्ट्रॉन का त्याग कर सकता है। इससे इसकी बची हुई बाहरी कक्षा दो इलेक्ट्रॉन से पूरी तरह भरी होगी।
लेकिन दोनों स्थिति में चार इलेक्ट्रॉन के ट्रांसफर के लिये अत्यधिक ऊर्जा की जरूरत पड़ेगी। सामान्य परिस्थितियों में यह संभव नहीं होता है। इसलिये कार्बन एक बेहतर रास्ता अपनाता है और इलेक्ट्रॉन की साझेदारी करके कोवैलेंट बॉन्ड बनाता है।
सिंगल बॉन्ड: एक जोड़ी (2) इलेक्ट्रॉन की साझेदारी से बनने वाले बॉन्ड को सिंगल बॉन्ड कहते हैं। सिंगल बॉन्ड से बनने वाले अणु का सबसे अच्छा उदाहरण है हाइड्रोजन का अणु।
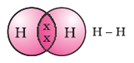
हाइड्रोजन की बाहरी कक्षा में 1 इलेक्ट्रॉन होता है। यह एक अन्य हाइड्रोजन परमाणु के साथ 1 इलेक्ट्रॉन साझा करता है। इस तरह से दोनों हाइड्रोजन की बाहरी कक्षा में 2 इलेक्ट्रॉन हो जाते हैं और उसका इलेक्ट्रॉनिक कंफिगरेशन अपने नजदीकी नोबल गैस जैसा हो जाता है।
डबल बॉन्ड: दो जोड़ी (4) इलेक्ट्रॉन की साझेदारी से बनने वाले बॉन्ड को डबल बॉन्ड कहते हैं। ऑक्सीजन का अणु डबल बॉन्ड का उदाहरण दिखाता है।
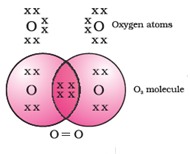
ऑक्सीजन (8): 2, 6
ऑक्सीजन की बाहरी कक्षा में 6 इलेक्ट्रॉन हैं। यह ऑक्सीजन के एक अन्य परमाणु के साथ 2 इलेक्ट्रॉन साझा करता है। इससे ऑक्सीजन की बाहरी कक्षा में अष्टक पूरा हो जाता है।
ट्रिपल बॉन्ड: तीन जोड़ी (6) इलेक्ट्रॉन साझा करने से बनने वाले बॉन्ड को ट्रिपल बॉन्ड कहते हैं। नाइट्रोजन का अणु ट्रिपल बॉन्ड का उदाहरण दिखाता है।
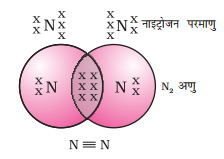
नाइट्रोजन (7): 2, 5
नाइट्रोजन की बाहरी कक्षा में 5 इलेक्ट्रॉन हैं। यह नाइट्रोजन के एक अन्य परमाणु के साथ 3 इलेक्ट्रॉन साझा करता है। इससे नाइट्रोजन की बाहरी कक्षा में अष्टक पूरा हो जाता है।